Необратимый характер тепловых процессов тепловые машины их применение
Содержание:
Необратимость тепловых процессов:
В термодинамическом процессе система переходит из начального состояния в конечное через промежуточные состояния.
Что такое обратимый процесс
Обратимым процессом называется процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния.
Например, все чистые механические процессы, которые проходят без трения, считаются примерами обратимого процесса. В частности, колебания тяжелого маятника, подвешенного на длинном крючке, будут близки к обратимому процессу. В этом случае кинетическая энергия практически полностью превращается в потенциальную энергию, то же самое происходит и в обратном порядке. Из-за того, что сопротивление среды мало, амплитуда колебания угасает медленно и процесс колебания продолжается долго.
Любые процессы, которые подвержены сопротивлению или передают тепло от горячего тела к холодному, необратимы. На практике все реальные процессы являются необратимыми процессами.
Процесс, описанный в примере с маятником, тоже является необратимым, так как невозможно полностью избавиться от трения. Поэтому часть механической энергии практически всегда превращается в тепло и безвозвратно расходуется в окружающую среду, т.е. в окружающих предметах происходят изменения, поэтому процесс называется необратимым.
Процесс передачи тепла от теплого тела к холодному тоже является примером необратимого процесса.
В целом в природе не существует обратимых процессов. Реальные процессы все считаются необратимыми. Обратимые процессы – это идеализированное понятие.
Внутренняя энергия
Вам известно, что термодинамическая система состоит из множества молекул и атомов. Система обладает внутренней энергией из-за того, что молекулы всегда находятся в движении, т.е. система обладает кинетической энергией. Вместе с этим, из-за существования силы взаимодействия между молекулами вещества, у молекул имеется потенциальная энергия взаимного действия.
Сумма кинетической энергии беспорядочного движения всех молекул и потенциальной энергии их взаимодействий называется внутренней энергией термодинамической системы.
Не нужно путать внутреннюю энергию тела с механической энергией. Если механическая энергия тела зависит от движения и расположения тела относительно других тел, то внутренняя энергия тела зависит от движения и расположения относительно друг друга частиц, составляющих это тело.
Внутренняя энергия является однозначной функцией термодинамической системы, т.е. каждому состоянию системы соответствует определенное значение внутренней энергии, которое абсолютно не зависит от того, каким образом система пришла в это состояние. Если газ нагреть, скорости молекул и атомов возрастут. Это приведет к росту внутренней энергии. Если изменится давление или удельный объем, то это тоже приведет к изменению внутренней энергии, так как изменится расстояние между молекулами. Значит, потенциальная энергия их взаимодействия тоже изменится.
Обычно внутренняя энергия системы при
Первый закон термодинамики. Рассмотрим пример нагревающегося чайника. Количество тепла 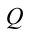
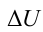
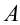
Это математическое выражение первого закона термодинамики.
Количество тепла, переданное термодинамической системе, равно сумме роста ее внутренней энергии и выполненной работе против внешних сил.
Если в систему передается количество тепла, 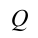
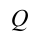
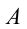
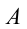
Первый закон термодинамики показывает, что создать вечный двигатель первого рода (на латыни «perpetuum mobile») невозможно. Согласно определению, «perpetuum mobile» первого рода – это непрерывно действующая машина, которая, будучи запущенной один раз, совершает работу без получения энергии извне. В первом же законе термодинамики, который является законом сохранения и превращения энергии, записано, что во всех процессах, встречающихся в природе, энергия сама по себе ниоткуда не появляется и никуда не исчезает, она может только превращаться из одного вида в другой.
Первый закон термодинамики
Первый закон термодинамики можно записать следующим образом:
Изменение внутренней энергии при переходе системы из одного состояния в другое равно сумме работы внешних сил (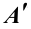
Хотя первый закон термодинамики описывает закон сохранения и превращения энергии, он не может показать направление прохождения термодинамических процессов. Например, первый закон может показать возможность перехода тепла от горячего тела к холодному, а также возможность перехода от холодного тела к горячему. При этом возникает вопрос: «Какие процессы в природе могут совершаться сами по себе?». На это может ответить второй закон термодинамики.
Второй закон термодинамики
Имеется несколько видов описаний этого закона, самый простой из них – описание Клаузиуса.
Тепло не переходит от тела с низкой температурой к телу с высокой температурой.
На практике тепло воды бесконечного океана может переходить само по себе к телу с более низкой относительно воды температурой. Для того чтобы передать тепло от тела с низкой температурой к телу с высокой температурой, нужно выполнить дополнительную работу. Но количество тепла не полностью расходуется на работу, часть его уходит на нагревание окружающих предметов. С этой точки зрения второй закон термодинамики в интерпретации Планка звучит следующим образом: в природе не существует процессов, в которых количество тепла полностью превращается в работу.
Для того чтобы тепло превратилось в работу, нужны нагреватель и охладитель.
В любых тепловых машинах только определенная часть передаваемой от нагревателя в охладитель энергии превращается в полезную работу. Возникает вопрос: «От каких величин зависит КПД тепловых машин и что нужно сделать, чтобы его увеличить?» На этот вопрос может ответить второй закон термодинамики в интерпретации Карно: Коэффициент полезного действия идеальной тепловой машины определяется только разницей температур, передающих тепло и принимающих тепло.
Законы термодинамики дают представление о том, какие тепловые машины возможно создать и на что нужно обратить внимание, чтобы увеличить их КПД.
Второй вид «perpetuum mobile». Второй вид «perpetuum mobile » основан на идее возможности использования энергии в большом количестве в водах океана без выполнения работы. А второй закон термодинамики утверждает, что без помощи может переходить тепло от горячего тела к холодному, для обратного процесса необходимо выполнить дополнительную работу. Из этого следует, что «perpetuum mobile» второго вида создать невозможно.
Если бы получилось создать «perpetuum mobile» второго рода, человечество обладало бы безграничным источником энергии. Если бы удалось понизить на 10 С температуру воды океана массой 1021 кг, то при этом выделилась бы тепловая энергия в количестве 1024 Дж. Если уголь, дающий такую же энергию, погрузить в железнодорожный состав, то длина состава будет равна 1010 км. Это расстояние почти равно диаметру солнечной системы.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Необратимость тепловых процессов. Второй закон термодинамики и его статический смысл. Тепловые машины и проблемы экологии.
1. Принцип действия тепловых двигателей. КПД теплового двигателя. Роль тепловых машин.
Тепловым двигателями называют машины, в которых внутренняя энергия топлива превращается в механическую энергию. Сегодня один из самых распространенных тепловых двигателей является ДВС. Принцип действия заключается в том, что энергия топлива переходит во внутреннюю энергию пара, а пар, расширяясь, совершает работу. Так внутренняя энергия пара превращается в кинетическую энергию поршня.
2.Только в идеальных условиях поная работа равна работе полезной. Отношение полезной работы к полной называется КПД. КПД любого мханизма всегда меньше 100%.
При распространении света проявляются его волновые свойства, а при взаимодействии с веществом обнаруживается его прерывистая структура, проявляемая, например, при фотоэффекте. Фотоэффектом называется вырывание электрона вещества под действием света. Различают два вида: внешний заключается в испускании электронов с поверхности вещества, внутренний связан с перераспределением электронов атомов по их состоянию в твердом теле, при поглощении им электромагнитного излучения. Установлен закон: максимальная скорость вылетающих электронов зависит от частоты колебаний электромагнитной волны и растет с увеличением частоты. Hv=Aвых + mV^2/2, где h постоянная Планка.
При испускании свет ведет себя подобно потоку частиц с энергией E=hv, зависящей от частоты испускания. Сама световая частица получила название фотон, или световой квант. Энергия фотона часто выражается через циклическую частоту w=2Пv h-=h/2п=1.05*10^-34 Дж*с Тогда E = hv=h-w E=mc^2 Тогда m=hv/c^2/ Фотон не имеет массы. Таким образом p=mc=hv/c=h/лямда.
На основе внешнего фотоэффекта работают фотоэлементы (турникет в метро)Фотодиоды для измерения распределение температуры слабо нагретых тел. Солнечные батареи в космических аппаратах.
Все макроскопические процессы в природе протекают только в одном направлении. В обратном направлении они самопроизвольно протекать не могут. Необратимыми процессами называются такие процессы, которые могут самопроизвольно протекать только в одном направлении; в обратном направлении они могут протекать только как одно из звеньев более сложного процесса. Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе. Второй закон ТД: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах (теплота сама собой переходит всегда от горячих тел к более холодным). В холодильниках охлаждение достигается за счет совершения работы. Важность этого закона состоит в том, что из него можно вывести заключение о необратимости не только процесса теплопередачи, но и других процессов в природе.
Энергия кванта равна: ε γ = hυ. Планк получил формулу спектральной светимости: rυ = (2πυ2/c2)*(hυ/ehυ/(kT) – 1).
Опыты Франка и Герца. Принцип соответствия.
Электризация — это сообщение телу электрического заряда. Электризация может происходить, например, при соприкосновении (трении) разнородных веществ и при облучении. При электризации в теле возникает избыток или недостаток электронов.В случае избытка электронов тело приобретает отрицательный заряд, в случае недостатка — положительный.
Законы взаимодействия неподвижных электрических зарядов изучает электростатика.Основной закон электростатики был экспериментально установлен французским физиком Шарлем Кулоном и читается так. Модуль силы взаимодействия двух точечных неподвижных электрических зарядов в вакууме прямо пропорционален произведению величин этих зарядов и обратно пропорционален квадрату расстояния между ними.
С использованием электрической постоянной закон Кулона имеет вид:F=(1/4π ε0 )• (q1q2/r 2 )Взаимодействие неподвижных электрических зарядов называютэлектростатическим, иликулоновским, взаимодействием. Кулоновские силы можно изобразить графически (рис. 14, 15).

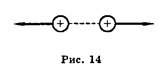
притяжения при разных знаках зарядов и силой отталкивания при одинаковых знаках.
2. Слово «атом» в переводе с греческого означает «неделимый». Под атомом долгое время, вплоть до начала XX в., подразумевали мельчайшие неделимые частицы вещества. К началуXX в. внауке накопилось много фактов, говоривших о сложном строении атомов.
Это означает, что электрон (например, в атоме водорода) может находиться на нескольких вполне определенных орбитах. Каждой орбите электрона соответствует вполне определенная энергия.
При переходе электрона с ближней орбиты на более удаленную, атомная система поглощает квант энергии. При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру атомная система излучает квант энергии. Принцип соответствия: применение новой, более общей физической теории к предметной области, где справедлива менее общая физическая теория, должно дать те же результаты, что и при использовании расчетных соотношений последней.
Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии
Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами:
Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. На рис. 3.12.1 изображены устройства, запрещенные первым законом термодинамики.
Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
Первый закон термодинамики не устанавливает направления тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
Если рабочее тело тепловой машины приводится в контакт с тепловым резервуаром, температура которого в процессе теплообмена остается неизменной, то единственным обратимым процессом будет изотермический квазистатический процесс, протекающий при бесконечно малой разнице температур рабочего тела и резервуара. При наличии двух тепловых резервуаров с разными температурами обратимым путем можно провести процессы на двух изотермических участках. Поскольку адиабатический процесс также можно проводить в обоих направлениях (адиабатическое сжатие и адиабатическое расширение), то круговой процесс, состоящий из двух изотерм и двух адиабат (цикл Карно) является единственным обратимым круговым процессом, при котором рабочее тело приводится в тепловой контакт только с двумя тепловыми резервуарами. Все остальные круговые процессы, проводимые с двумя тепловыми резервуарами, необратимы.
Процессы превращения механической работы во внутреннюю энергию тела являются необратимыми из-за наличия трения, процессов диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик Уильям Кельвин дал в 1851 г. следующую формулировку второго закона:
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют вечным двигателем второго рода. В земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 10 21 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈ 10 24 Дж), эквивалентное полному сжиганию 10 17 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 10 4 раз меньше. Поэтому вечный двигатель второго рода был бы для человечества не менее привлекателен, чем вечный двигатель первого рода, запрещенный первым законом термодинамики.
Немецкий физик Рудольф Клаузиус дал другую формулировку второго закона термодинамики:
Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.
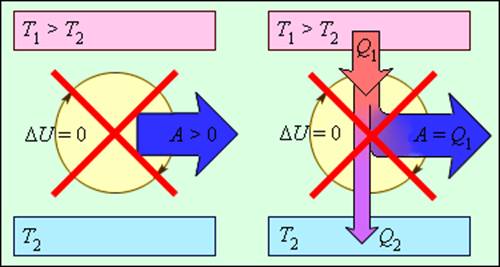
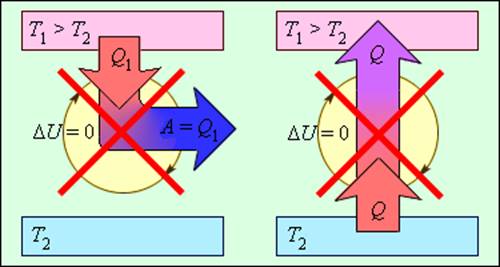
На рис. 3.12.2 изображены процессы, запрещенные вторым законом, но не запрещенные первым законом термодинамики. Эти процессы соответствуют двум формулировкам второго закона термодинамики.
Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)
Следует отметить, что обе формулировки второго закона термодинамики эквивалентны. Если допустить, например, что тепло может самопроизвольно (т. е. без затраты внешней работы) переходить при теплообмене от холодного тела к горячему, то можно прийти к выводу о возможности создания вечного двигателя второго рода. Действительно, пусть реальная тепловая машина получает от нагревателя количество теплоты Q1 и отдает холодильнику количество теплоты Q2. При этом совершается работа A = Q1 – |Q2|. Если бы количество теплоты |Q2| самопроизвольно переходило от холодильника к нагревателю, то конечным результатом работы реальной тепловой машины и идеальной холодильной машины было бы превращение в работу количества теплоты Q1 – |Q2|, полученного от нагревателя без какого-либо изменения в холодильнике. Таким образом, комбинация реальной тепловой машины и идеальной холодильной машины равноценна вечному двигателю второго рода. Точно также можно показать, что комбинация реальной холодильной машины и вечного двигателя второго рода равноценна идеальной холодильной машине.
Второй закон термодинамики непосредственно связан с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, т. е. он не может быть осуществлен полностью в обратном направлении.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
На основании любой из формулировок второго закона термодинамики могут быть доказаны следующие утверждения, которые называются теоремами Карно:
1. Коэффициент полезного действия тепловой машины, работающей при данных значениях температур нагревателя и холодильника, не может быть больше, чем коэффициент полезного действия машины, работающей по обратимому циклу Карно при тех же значениях температур нагревателя и холодильника.
2. Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Таким образом, коэффициент полезного действия машины, работающей по циклу Карно, максимален.
Знак равенства в этом соотношении соответствует обратимым циклам. Для машин, работающих по циклу Карно, это соотношение может быть переписано в виде
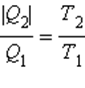 или или 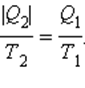 |
В каком бы направлении ни обходился цикл Карно (по или против часовой стрелки) величины Q1 и Q2 всегда имеют разные знаки. Поэтому можно записать
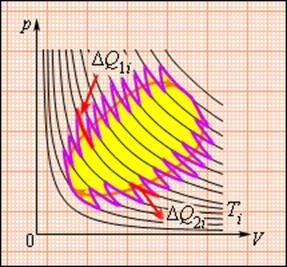
Это соотношение может быть обобщено на любой замкнутый обратимый процесс, который можно представить как последовательность малых изотермических и адиабатических участков (рис. 3.12.3).
Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков
При полном обходе замкнутого обратимого цикла
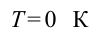


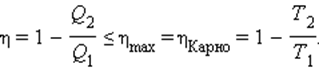
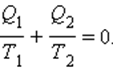

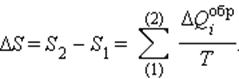
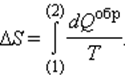
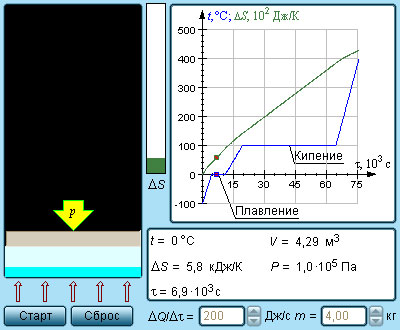
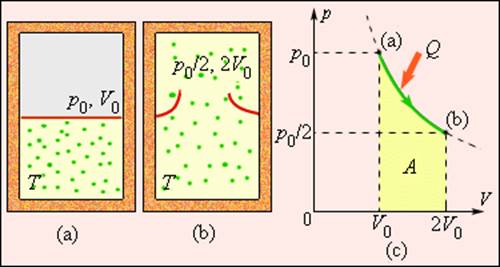
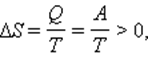 где A = Q – работа газа при обратимом изотермическом расширении
где A = Q – работа газа при обратимом изотермическом расширении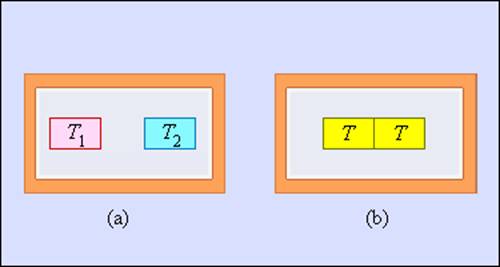
 где
где 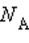 – число Авогадро. Каждый из них является микросостоянием. Только одно из микросостояний соответствует случаю, когда все молекулы соберутся в одной половинке (например, правой) сосуда. Вероятность такого события практически равна нулю. Наибольшее число микросостояний соответствует равновесному состоянию, при котором молекулы равномерно распределены по всему объему. Поэтому равновесное состояние является наиболее вероятным. С другой стороны равновесное состояние является состоянием наибольшего беспорядка в термодинамической системе и состоянием с максимальной энтропией.
– число Авогадро. Каждый из них является микросостоянием. Только одно из микросостояний соответствует случаю, когда все молекулы соберутся в одной половинке (например, правой) сосуда. Вероятность такого события практически равна нулю. Наибольшее число микросостояний соответствует равновесному состоянию, при котором молекулы равномерно распределены по всему объему. Поэтому равновесное состояние является наиболее вероятным. С другой стороны равновесное состояние является состоянием наибольшего беспорядка в термодинамической системе и состоянием с максимальной энтропией.